臨床成績
各薬剤のご使用にあたりましては、各製品電子添文をご参照ください。
本剤の「警告・禁忌を含む注意事項等情報」等は電子電文をご参照ください。
国内第Ⅰ/Ⅱ相試験(OP-01-001試験)(評価資料)
(多施設共同、非盲検、非対照試験、2012-2014年) 承認時評価資料:国内第Ⅰ/Ⅱ相試験(OP-01-001試験)
- 目 的
- 登録時25歳以下の小児及び若年成人でALL又は骨髄浸潤のあるLBLに罹患した患者のうち、既承認の大腸菌由来L-アスパラギナーゼ製剤の投与に起因するアレルギー反応の既往がある寛解期の患者に対して、強化療法としてのアーウィナーゼ®(エルウィニアL-アスパラギナーゼ)(以下、本剤)、PSL、VCR、THP-ADRの併用療法を実施する際の本剤の用量探索(第Ⅰ相)、安全性評価と有効性探索(第Ⅱ相)、及び酵素製剤としての作用評価(薬物動態試験)を実施し、日本人小児及び若年成人での上記併用療法における本剤のRDを決定し、薬物動態を含めた有効性と安全性を総合的に評価する。
- 対 象
- 登録時25歳以下の小児及び若年成人でALL又は骨髄浸潤のあるLBLに罹患した患者のうち、既承認の大腸菌由来L-アスパラギナーゼ製剤の投与に起因するアレルギー反応の既往がある寛解期の患者
・治験薬投与例数:第Ⅰ相試験6例、第Ⅱ相試験18例、合計24例
・最大の解析対象集団(Full Analysis Set:FAS):第Ⅰ相試験6例、第Ⅱ相試験17例、合計23例
・治験実施計画書に適合した解析対象集団(Per Protocol Set:PPS):第Ⅰ相試験6例、第Ⅱ相試験17例、合計23例
・安全性解析対象集団:第Ⅰ相試験6例、第Ⅱ相試験18例、合計24例
・薬物動態解析対象集団:第Ⅰ相試験6例、第Ⅱ相試験17例、合計23例
- 方 法
- 本剤にPSL、VCR、THP-ADRの3つの抗悪性腫瘍剤を併用する全15日間の併用療法である。
プロトコール治療の開始日をDay1と定義し、追跡期間を含めたDay28までを本試験のプロトコール治療期間と定義した。
本剤は、Day2、5、7、9、11、13(週3回、2週間、計6回)に筋肉内投与した。
<投与スケジュール>
| 薬剤名 | 投与量 | 投与法 | Day | ||||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | |||
| PSL | 40mg/m2 (最大 60mg) |
経口投与 (分 3) |
|||||||||||||||
| VCR | 1.5mg/m2 (最大 2mg) |
静脈内投与 (緩徐) |
△ | △ | △ | ||||||||||||
| THP-ADR | 20mg/m2 (上限なし) |
静脈内投与 (1 時間点滴) |
□ | □ | |||||||||||||
| アーウィナーゼ® | * | 筋肉内投与 | |||||||||||||||
第Ⅰ相試験
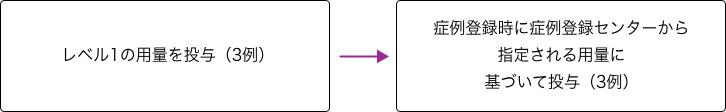
本剤の用量レベルは表に示す通りであり、最初の3例にレベル1の用量を投与し、4例目以降はDLT発現の有無が確定している3例の患者情報により、症例登録時に症例登録センターから指定される用量に基づいて投与した。
表 アーウィナーゼ®の用量レベル
| アーウィナーゼ® 用量レベル | 1 日(1 回)用量 |
|---|---|
| レベル 1(開始用量) | 25,000U/m2 (上限なし) |
| レベル 0 | 20,000U/m2 (上限なし) |
<試験デザイン>
(主な選択基準)
・登録時年齢が1歳以上25歳以下である患者
・ALL又は骨髄浸潤のあるLBLと診断されており、第一又は第二寛解期である患者
・既承認のL-アスパラギナーゼ製剤の投与に起因するアレルギー反応の既往がある患者
(主な除外基準)
・成熟B細胞性(バーキット型)ALLの患者
・以前に本剤の投与を受けた患者
・Grade2以上の膵炎の既往歴のある患者
<評価項目>
- 主要評価項目:
- 推奨用量の決定
- 副次評価項目:
- 1) 用量制限毒性の同定
2) プロトコール治療期間による有害事象及び副作用の頻度と重症度
(用量レベルごと)
第Ⅱ相試験
第Ⅰ相試験終了後の中間解析によって決定されたRDに基づいて投与した。
(主な選択基準)
・登録時年齢が1歳以上25歳以下である患者
・ALL又は骨髄浸潤のあるLBLと診断されており、第一又は第二寛解期である患者
・既承認のL-アスパラギナーゼ製剤の投与に起因するアレルギー反応の既往がある患者
(主な除外基準)
・成熟B細胞性(バーキット型)ALLの患者
・以前に本剤の投与を受けた患者
・Grade2以上の膵炎の既往歴のある患者
<評価項目>
- 主要評価項目:
- 薬物動態試験における評価項目のデータを含めた総合的解析による有効性の探索
- 副次評価項目:
- 1) 寛解維持割合 2) 推奨用量のプロトコール治療期間による有害事象及び副作用の頻度と重症度
薬物動態試験
酵素製剤としての作用を評価した。
<評価項目>
- 主要評価項目:
- 本剤1回目投与48時間後のトラフレベルの血漿L-アスパラギナーゼ活性値
- 副次評価項目:
- 1) 血漿L-アスパラギナーゼ活性値をパラメータとした本剤の血中薬物動態 2) 本剤1回目及び6回目投与72時間後の血漿L-アスパラギナーゼ活性値 3) 本剤1回目投与48時間後の血漿アスパラギン濃度 4) 本剤6回目投与前(5回目投与48時間後)及び72時間後の血漿アスパラギン濃度
- 解析計画
- 第Ⅰ相試験では、RD、DLTの発現頻度をPPSを対象として解析した。第Ⅰ相試験、第Ⅱ相試験及び第Ⅰ/Ⅱ相試験の併合では、血漿L-アスパラギナーゼ活性値、血漿アスパラギン濃度の集計は、薬物動態解析対象集団を対象に実施し、寛解維持割合はPPSを対象に実施した。安全性の評価については、白血病の状態ではPPSを対象とし、それ以外の評価項目については安全性解析対象集団を対象として評価した。薬物動態及び薬力学については、薬物動態解析対象集団を対象に解析した。
患者背景(安全性解析対象集団)
国内第Ⅰ/Ⅱ相試験(OP-01-001試験)の患者背景は以下の通りであった。
例数(%)
| 項目 | 第Ⅰ相 | 第Ⅱ相 | 第Ⅰ / Ⅱ相 | ||
| n=6 | n=18 | n=24 | |||
| 性別 | 男性 | 1 ( 16.7) | 14 ( 77.8) | 15 ( 62.5) | |
| 女性 | 5 ( 83.3) | 4 ( 22.2) | 9 ( 37.5) | ||
| 年齢(歳) | 例数 | 6 | 18 | 24 | |
| 平均値±標準偏差 | 7.8 ± 5.0 | 8.4 ± 4.1 | 8.3 ± 4.3 | ||
| 最小値 , 最大値 | 2, 15 | 2, 16 | 2, 16 | ||
| 12 歳未満 | 4 ( 66.7) | 14 ( 77.8) | 18 ( 75.0) | ||
| 12 歳以上 | 2 ( 33.3) | 4 ( 22.2) | 6 ( 25.0) | ||
| 身長(cm) | 例数 | 6 | 18 | 24 | |
| 平均値±標準偏差 | 123.15 ± 26.90 | 127.32 ± 24.34 | 126.28 ± 24.47 | ||
| 最小値 , 最大値 | 86.4, 155.0 | 83.2, 170.1 | 83.2, 170.1 | ||
| 体重(kg) | 例数 | 6 | 18 | 24 | |
| 平均値±標準偏差 | 28.72 ± 13.22 | 31.86 ± 14.24 | 31.07 ± 13.77 | ||
| 最小値 , 最大値 | 14.0, 48.4 | 11.0, 56.8 | 11.0, 56.8 | ||
| 体表面積(m2) | 例数 | 6 | 18 | 24 | |
| 平均値±標準偏差 | 0.985 ± 0.330 | 1.050 ± 0.336 | 1.034 ± 0.329 | ||
| 最小値 , 最大値 | 0.58, 1.44 | 0.50, 1.64 | 0.50, 1.64 | ||
| 薬物アレルギーの有無 | 無 | 6 (100.0) | 17 ( 94.4) | 23 ( 95.8) | |
| 有 | 0 | 1 ( 5.6) | 1 ( 4.2) | ||
| 既往歴 / 合併症の有無 | 無 | 2 ( 33.3) | 1 ( 5.6) | 3 ( 12.5) | |
| 有 | 4 ( 66.7) | 17 ( 94.4) | 21 ( 87.5) | ||
| 前治療(化学療法)の有無 | 無 | 0 | 0 | 0 | |
| 有 | 6 (100.0) | 18 (100.0) | 24 (100.0) | ||
| 前治療(放射線療法)の有無 | 無 | 6 (100.0) | 18 (100.0) | 24 (100.0) | |
| 有 | 0 | 0 | 0 | ||
| 併用薬剤の有無 | 無 | 0 | 0 | 0 | |
| 有 | 6 (100.0) | 18 (100.0) | 24 (100.0) | ||
| L-アスパラギナーゼ製剤による アレルギーの有無 |
無 | 0 | 0 | 0 | |
| 有 | 6 (100.0) | 18 (100.0) | 24 (100.0) | ||
| PS | 50 | 0 | 0 | 0 | |
| 60 | 0 | 0 | 0 | ||
| 70 | 0 | 0 | 0 | ||
| 80 | 0 | 1 ( 5.6) | 1 ( 4.2) | ||
| 90 | 0 | 1 ( 5.6) | 1 ( 4.2) | ||
| 100 | 6 (100.0) | 16 ( 88.9) | 22 ( 91.7) | ||
| 診断の分類 | ALL | B 前駆細胞型 | 6 (100.0) | 15 ( 83.3) | 21 ( 87.5) |
| T 細胞型 | 0 | 2 ( 11.1) | 2 ( 8.3) | ||
| その他 | 0 | 0 | 0 | ||
| LBL | B 細胞型 | 0 | 1 ( 5.6) | 1 ( 4.2) | |
| T 細胞型 | 0 | 0 | 0 | ||
| その他 | 0 | 0 | 0 | ||
| 寛解期の内訳 | 第一寛解期 | 6 (100.0) | 13 ( 72.2) | 19 ( 79.2) | |
| 第二寛解期 | 0 | 5 ( 27.8) | 5 ( 20.8) | ||
| 初発時白血球数(×103/μL) | 例数 | 6 | 17 | 23 | |
| 平均値±標準偏差 | 30.310 ± 49.872 | 74.902 ± 86.887 | 63.269 ± 80.352 | ||
| 最小値 , 最大値 | 3.20, 131.00 | 1.50, 305.70 | 1.50, 305.70 | ||
有効性
RDの決定(第Ⅰ相試験)【主要評価項目、PPS】
本剤の用量レベル1で6例に投与され、全例でDLTの発現がなく、レベル0に移行した患者はいなかった。効果安全性評価委員会で検討した結果、レベル1である1回用量25,000U/m2をRDとして決定した。
1回目投与48時間後の血漿L-アスパラギナーゼ活性値が0.1U/mL以上であった患者の割合
(第Ⅱ相試験)【主要評価項目、薬物動態解析対象集団】
第Ⅱ相試験では、1回目投与48時間後の血漿L-アスパラギナーゼ活性値が0.1U/mL以上であった患者の割合[90%CI] は、100[83.8, 100]%であった。
血漿L-アスパラギナーゼ活性値(0.1U/mL以上)の集計(第Ⅰ/Ⅱ相試験)
【主要評価項目、薬物動態解析対象集団】
第Ⅰ/Ⅱ相試験の併合解析では、1回目投与48時間後に100.0%(23/23例)の患者で血漿L-アスパラギナーゼ活性値が0.1U/mL以上であった。
例数(%)
| 評価時期 | 第Ⅰ相 | 第Ⅱ相 | 第Ⅰ / Ⅱ相 | |
| n=6 | n=17 | n=23 | ||
| 1 回目 | 投与開始前 | 0 | 0 | 0 |
| 投与 4 時間後 | 6 | 17 (100.0) | 23 (100.0) | |
| 投与 8 時間後 | 6 | 17 (100.0) | 23 (100.0) | |
| 投与 12 時間後 | 6 | 17 (100.0) | 23 (100.0) | |
| 投与 24 時間後 | 6 | 17 (100.0) | 23 (100.0) | |
| 投与 48 時間後 | 6 | 17 (100.0) | 23 (100.0) | |
| 投与 72 時間後 | 5 | 13 ( 76.5) | 18 ( 78.3) | |
| 3 回目 | 投与 48 時間後 | 5 | 16 ( 94.1) | 21 ( 91.3) |
| 5 回目 | 投与 48 時間後 | 5 | 16 ( 94.1) | 21 ( 91.3) |
| 6 回目 | 投与 72 時間後 | 5 | 14 ( 82.4) | 19 ( 82.6) |
| 投与 1 週間後 | 0 | 0 | 0 | |
血漿アスパラギン濃度(3μmol/L以下)の集計(第Ⅰ/Ⅱ相試験)
【主要評価項目、薬物動態解析対象集団】
第Ⅰ/Ⅱ相試験の併合解析では、1回目投与48時間後に95.7%(22/23例)の患者で血漿アスパラギン濃度が3μmol/L以下に枯渇した。3回目及び5回目投与48時間後には、いずれも100.0%(23/23例)、1回目投与72時間後及び6回目投与72時間後には、いずれも95.7%(22/23例)、6回目投与1週間後には、13.0%(3/23例)の患者で血漿アスパラギン濃度が3μmol/L以下に枯渇した。
例数(%)
| 評価時期 | 第Ⅰ相 | 第Ⅱ相 | 第Ⅰ / Ⅱ相 | |
| n=6 | n=17 | n=23 | ||
| 1 回目 | 投与開始前 | 0 | 0 | 0 |
| 投与 48 時間後 | 6 | 16 ( 94.1) | 22 ( 95.7) | |
| 投与 72 時間後 | 6 | 16 ( 94.1) | 22 ( 95.7) | |
| 3 回目 | 投与 48 時間後 | 6 | 17 (100.0) | 23 (100.0) |
| 5 回目 | 投与 48 時間後 | 6 | 17 (100.0) | 23 (100.0) |
| 6 回目 | 投与 72 時間後 | 6 | 16 ( 94.1) | 22 ( 95.7) |
| 投与 1 週間後 | 2 | 1 ( 5.9) | 3 ( 13.0) | |
抗腫瘍効果の評価(第Ⅱ相試験) 【副次評価項目、PPS】
第Ⅱ相試験では、PPSに採用された17例全例が寛解と判断された(Day28で評価)。
例数(%)
| 第Ⅰ相 | 第Ⅱ相 | 第Ⅰ / Ⅱ相 | |
| n=6 | n=17 | n=23 | |
| 寛解 | 6 | 17 (100.0) | 23 (100.0) |
| 非寛解 | 0 | 0 | 0 |
安全性
有害事象(第Ⅰ/Ⅱ相試験) 【副次評価項目、安全性解析対象集団】
第Ⅰ/Ⅱ相試験の併合解析において、有害事象は安全性解析対象集団100.0%(24/24例)389件に認められた。発現頻度が最も高かった有害事象は好中球数減少で95.8%(23/24例)であり、次いで白血球数減少が91.7%(22/24例)、アラニンアミノトランスフェラーゼ増加が87.5%(21/24例)、アスパラギン酸アミノトランスフェラーゼ増加及び血中フィブリノゲン減少がそれぞれ83.3%(20/24例)、アンモニア増加が66.7%(16/24例)、リンパ球数減少が58.3%(14/24例)、アンチトロンビンⅢ減少が54.2%(13/24例)、血小板数減少が50.0%(12/24例)、血中アルブミン減少、血中ビリルビン増加及びC-反応性蛋白増加がそれぞれ45.8%(11/24例)、血中トリグリセリド増加及びヘモグロビン減少がそれぞれ41.7%(10/24例)であった。死亡、重篤な有害事象及び投与中止に至った有害事象は認められなかった。
| 器官別大分類 基本語 |
第Ⅰ / Ⅱ相 n=24 |
|
| 例数(%) | 件数 | |
| すべての有害事象 | 24 (100.0) | 389 |
| 血液およびリンパ系障害 | 12 ( 50.0) | 20 |
| 発熱性好中球減少症 | 8 ( 33.3) | 10 |
| 貧血 | 5 ( 20.8) | 5 |
| 低フィブリノゲン血症 | 3 ( 12.5) | 3 |
| 白血球減少症 | 1 ( 4.2) | 1 |
| 好中球減少症 | 1 ( 4.2) | 1 |
| 耳および迷路障害 | 1 ( 4.2) | 1 |
| 耳鳴 | 1 ( 4.2) | 1 |
| 胃腸障害 | 19 ( 79.2) | 34 |
| 嘔吐 | 9 ( 37.5) | 13 |
| 便秘 | 5 ( 20.8) | 5 |
| 下痢 | 4 ( 16.7) | 5 |
| 悪心 | 4 ( 16.7) | 4 |
| 腹痛 | 2 ( 8.3) | 2 |
| 肛門周囲痛 | 2 ( 8.3) | 2 |
| 肛門周囲紅斑 | 2 ( 8.3) | 2 |
| 上腹部痛 | 1 ( 4.2) | 1 |
| 一般・全身障害および投与部位の状態 | 10 ( 41.7) | 12 |
| 発熱 | 4 ( 16.7) | 4 |
| 疼痛 | 3 ( 12.5) | 3 |
| 疲労 | 1 ( 4.2) | 1 |
| 注射部位疼痛 | 1 ( 4.2) | 1 |
| 倦怠感 | 1 ( 4.2) | 1 |
| 炎症 | 1 ( 4.2) | 1 |
| 医療機器閉塞 | 1 ( 4.2) | 1 |
| 感染症および寄生虫症 | 2 ( 8.3) | 3 |
| 菌血症 | 1 ( 4.2) | 1 |
| 気管支炎 | 1 ( 4.2) | 1 |
| 咽頭炎 | 1 ( 4.2) | 1 |
| 傷害、中毒および処置合併症 | 1 ( 4.2) | 1 |
| 靱帯捻挫 | 1 ( 4.2) | 1 |
| 臨床検査 | 24 (100.0) | 270 |
| 好中球数減少 | 23 ( 95.8) | 23 |
| 白血球数減少 | 22 ( 91.7) | 22 |
| アラニンアミノトランスフェラーゼ増加 | 21 ( 87.5) | 21 |
| アスパラギン酸アミノトランスフェラーゼ増加 | 20 ( 83.3) | 20 |
| 血中フィブリノゲン減少 | 20 ( 83.3) | 20 |
| アンモニア増加 | 16 ( 66.7) | 16 |
| リンパ球数減少 | 14 ( 58.3) | 14 |
| アンチトロンビンⅢ減少 | 13 ( 54.2) | 13 |
| 血小板数減少 | 12 ( 50.0) | 12 |
| 血中アルブミン減少 | 11 ( 45.8) | 11 |
| 血中ビリルビン増加 | 11 ( 45.8) | 11 |
| C-反応性蛋白増加 | 11 ( 45.8) | 11 |
| 血中トリグリセリド増加 | 10 ( 41.7) | 10 |
| ヘモグロビン減少 | 10 ( 41.7) | 10 |
| 活性化部分トロンボプラスチン時間延長 | 6 ( 25.0) | 8 |
| 血中ブドウ糖減少 | 6 ( 25.0) | 6 |
| 器官別大分類 基本語 |
第Ⅰ / Ⅱ相 n=24 |
|
| 例数(%) | 件数 | |
| アミラーゼ増加 | 5 ( 20.8) | 5 |
| 血中乳酸脱水素酵素増加 | 5 ( 20.8) | 5 |
| 総蛋白減少 | 5 ( 20.8) | 5 |
| 血中コレステロール増加 | 4 ( 16.7) | 4 |
| 血中尿素増加 | 4 ( 16.7) | 4 |
| 血中ブドウ糖増加 | 3 ( 12.5) | 3 |
| 血中ナトリウム減少 | 3 ( 12.5) | 3 |
| 抱合ビリルビン増加 | 2 ( 8.3) | 2 |
| 血中フィブリノゲン増加 | 2 ( 8.3) | 2 |
| 活性化部分トロンボプラスチン時間短縮 | 1 ( 4.2) | 1 |
| 血中カルシウム減少 | 1 ( 4.2) | 1 |
| 血中マグネシウム増加 | 1 ( 4.2) | 1 |
| 血圧上昇 | 1 ( 4.2) | 1 |
| 単球数減少 | 1 ( 4.2) | 1 |
| プロトロンビン時間延長 | 1 ( 4.2) | 1 |
| プロトロンビン時間短縮 | 1 ( 4.2) | 1 |
| 血中リン増加 | 1 ( 4.2) | 1 |
| 血中アルカリホスファターゼ増加 | 1 ( 4.2) | 1 |
| 代謝および栄養障害 | 11 ( 45.8) | 16 |
| 高アンモニア血症 | 7 ( 29.2) | 7 |
| 高トリグリセリド血症 | 2 ( 8.3) | 2 |
| 食欲減退 | 2 ( 8.3) | 2 |
| 高コレステロール血症 | 1 ( 4.2) | 1 |
| 高尿酸血症 | 1 ( 4.2) | 1 |
| 低アルブミン血症 | 1 ( 4.2) | 1 |
| 低ナトリウム血症 | 1 ( 4.2) | 1 |
| 食欲亢進 | 1 ( 4.2) | 1 |
| 筋骨格系および結合組織障害 | 4 ( 16.7) | 5 |
| 背部痛 | 4 ( 16.7) | 4 |
| 四肢痛 | 1 ( 4.2) | 1 |
| 神経系障害 | 8 ( 33.3) | 10 |
| 頭痛 | 5 ( 20.8) | 6 |
| 末梢性ニューロパチー | 2 ( 8.3) | 3 |
| 神経痛 | 1 ( 4.2) | 1 |
| 精神障害 | 1 ( 4.2) | 1 |
| 気分変調性障害 | 1 ( 4.2) | 1 |
| 呼吸器、胸郭および縦隔障害 | 4 (16.7) | 4 |
| 鼻出血 | 2 ( 8.3) | 2 |
| 咳嗽 | 1 ( 4.2) | 1 |
| 上気道の炎症 | 1 ( 4.2) | 1 |
| 皮膚および皮下組織障害 | 7 (29.2) | 8 |
| 脱毛症 | 2 ( 8.3) | 2 |
| そう痒症 | 2 ( 8.3) | 2 |
| 蕁麻疹 | 2 ( 8.3) | 2 |
| 皮膚乾燥 | 1 ( 4.2) | 1 |
| 皮膚硬結 | 1 ( 4.2) | 1 |
| 血管障害 | 4 (16.7) | 4 |
| 高血圧 | 3 (12.5) | 3 |
| 血管炎 | 1 ( 4.2) | 1 |
MedDRA/J version 17.0
注1:同一患者において同一の器官別大分類又は基本語の有害事象が複数回発現した場合は、各分類で1例として取り扱った。重要な有害事象(第Ⅰ/Ⅱ相試験)【安全性解析対象集団】
本試験では、過敏症(過敏症、蕁麻疹)、高血糖(血中ブドウ糖増加)、トランスアミナーゼ増加(アラニンアミノトランスフェラーゼ増加、アスパラギン酸アミノトランスフェラーゼ増加)、凝固系障害(低フィブリノゲン血症、血中フィブリノゲン減少、アンチトロンビンⅢ減少、活性化部分トロンボプラスチン時間延長、プロトロンビン時間短縮)及び膵炎(膵炎、アミラーゼ増加)を重要な有害事象とした。
| 器官別大分類 基本語 |
第Ⅰ / Ⅱ相 n=24 |
|
| 例数(%) | 件数 | |
| すべての重要な有害事象 | 24 (100.0) | 96 |
| 血液およびリンパ系障害 | 3 ( 12.5) | 3 |
| 低フィブリノゲン血症 | 3 ( 12.5) | 3 |
| 臨床検査 | 24 (100.0) | 91 |
| アラニンアミノトランスフェラーゼ増加 | 21 ( 87.5) | 21 |
| アスパラギン酸アミノトランスフェラーゼ増加 | 20 ( 83.3) | 20 |
| 血中フィブリノゲン減少 | 20 ( 83.3) | 20 |
| アンチトロンビンⅢ減少 | 13 ( 54.2) | 13 |
| 活性化部分トロンボプラスチン時間延長 | 6 ( 25.0) | 8 |
| アミラーゼ増加 | 5 ( 20.8) | 5 |
| 血中ブドウ糖増加 | 3 ( 12.5) | 3 |
| プロトロンビン時間短縮 | 1 ( 4.2) | 1 |
| 皮膚および皮下組織障害 | 2 ( 8.3) | 2 |
| 蕁麻疹 | 2 ( 8.3) | 2 |
MedDRA/J version 17.0
注2:同一患者において同一の器官別大分類又は基本語の有害事象が複数回発現した場合は、各分類で1例として取り扱った。副作用の発現頻度(第Ⅰ/Ⅱ相試験) 【安全性解析対象集団】
第Ⅰ/Ⅱ相試験の併合解析において、副作用は安全性解析対象集団100.0%(24/24例)249件に認められた。発現頻度が最も高かった副作用は血中フィブリノゲン減少で83.3%(20/24例)であり、次いでアンモニア増加が66.7%(16/24例)、アラニンアミノトランスフェラーゼ増加が62.5%(15/24例)、アスパラギン酸アミノトランスフェラーゼ増加が58.3%(14/24例)、アンチトロンビンⅢ減少が54.2%(13/24例)、血中アルブミン減少が45.8%(11/24例)、血中トリグリセリド増加及び白血球数減少がそれぞれ41.7%(10/24例)であった。
| 器官別大分類 基本語 |
第Ⅰ / Ⅱ相 n=24 |
|
| 例数(%) | 件数 | |
| すべての副作用 | 24 (100.0) | 249 |
| 血液およびリンパ系障害 | 7 ( 29.2) | 11 |
| 貧血 | 4 ( 16.7) | 4 |
| 発熱性好中球減少症 | 3 ( 12.5) | 3 |
| 低フィブリノゲン血症 | 3 ( 12.5) | 3 |
| 好中球減少症 | 1 ( 4.2) | 1 |
| 耳および迷路障害 | 1 ( 4.2) | 1 |
| 耳鳴 | 1 ( 4.2) | 1 |
| 胃腸障害 | 7 ( 29.2) | 13 |
| 嘔吐 | 5 ( 20.8) | 6 |
| 下痢 | 2 ( 8.3) | 3 |
| 悪心 | 2 ( 8.3) | 2 |
| 腹痛 | 1 ( 4.2) | 1 |
| 便秘 | 1 ( 4.2) | 1 |
| 一般・全身障害および投与部位の状態 | 7 ( 29.2) | 8 |
| 発熱 | 4 ( 16.7) | 4 |
| 疼痛 | 2 ( 8.3) | 2 |
| 注射部位疼痛 | 1 ( 4.2) | 1 |
| 倦怠感 | 1 ( 4.2) | 1 |
| 感染症および寄生虫症 | 2 ( 8.3) | 3 |
| 菌血症 | 1 ( 4.2) | 1 |
| 気管支炎 | 1 ( 4.2) | 1 |
| 咽頭炎 | 1 ( 4.2) | 1 |
| 臨床検査 | 24 (100.0) | 187 |
| 血中フィブリノゲン減少 | 20 ( 83.3) | 20 |
| アンモニア増加 | 16 ( 66.7) | 16 |
| アラニンアミノトランスフェラーゼ増加 | 15 ( 62.5) | 15 |
| アスパラギン酸アミノトランスフェラーゼ増加 | 14 ( 58.3) | 14 |
| アンチトロンビンⅢ減少 | 13 ( 54.2) | 13 |
| 血中アルブミン減少 | 11 ( 45.8) | 11 |
| 血中トリグリセリド増加 | 10 ( 41.7) | 10 |
| 白血球数減少 | 10 ( 41.7) | 10 |
| 好中球数減少 | 9 ( 37.5) | 9 |
| 血中ビリルビン増加 | 8 ( 33.3) | 8 |
| 血小板数減少 | 7 ( 29.2) | 7 |
| C-反応性蛋白増加 | 6 ( 25.0) | 6 |
| リンパ球数減少 | 6 ( 25.0) | 6 |
| 器官別大分類 基本語 |
第Ⅰ / Ⅱ相 n=24 |
|
| 例数(%) | 件数 | |
| 活性化部分トロンボプラスチン時間延長 | 5 ( 20.8) | 5 |
| アミラーゼ増加 | 5 ( 20.8) | 5 |
| ヘモグロビン減少 | 5 ( 20.8) | 5 |
| 総蛋白減少 | 5 ( 20.8) | 5 |
| 血中ブドウ糖減少 | 4 ( 16.7) | 4 |
| 血中乳酸脱水素酵素増加 | 4 ( 16.7) | 4 |
| 血中尿素増加 | 3 ( 12.5) | 3 |
| 血中コレステロール増加 | 2 ( 8.3) | 2 |
| 血中フィブリノゲン増加 | 2 ( 8.3) | 2 |
| 血中ブドウ糖増加 | 2 ( 8.3) | 2 |
| 活性化部分トロンボプラスチン時間短縮 | 1 ( 4.2) | 1 |
| 抱合ビリルビン増加 | 1 ( 4.2) | 1 |
| 血中カルシウム減少 | 1 ( 4.2) | 1 |
| プロトロンビン時間短縮 | 1 ( 4.2) | 1 |
| 血中アルカリホスファターゼ増加 | 1 ( 4.2) | 1 |
| 代謝および栄養障害 | 8 ( 33.3) | 12 |
| 高アンモニア血症 | 7 ( 29.2) | 7 |
| 高コレステロール血症 | 1 ( 4.2) | 1 |
| 高トリグリセリド血症 | 1 ( 4.2) | 1 |
| 高尿酸血症 | 1 ( 4.2) | 1 |
| 低アルブミン血症 | 1 ( 4.2) | 1 |
| 食欲減退 | 1 ( 4.2) | 1 |
| 筋骨格系および結合組織障害 | 2 ( 8.3) | 3 |
| 背部痛 | 2 ( 8.3) | 2 |
| 四肢痛 | 1 ( 4.2) | 1 |
| 神経系障害 | 5 ( 20.8) | 5 |
| 頭痛 | 4 ( 16.7) | 4 |
| 末梢性ニューロパチー | 1 ( 4.2) | 1 |
| 呼吸器、胸郭および縦郭障害 | 2 ( 8.3) | 2 |
| 鼻出血 | 1 ( 4.2) | 1 |
| 上気道の炎症 | 1 ( 4.2) | 1 |
| 皮膚および皮下組織障害 | 3 ( 12.5) | 3 |
| 脱毛症 | 1 ( 4.2) | 1 |
| そう痒症 | 1 ( 4.2) | 1 |
| 皮膚硬結 | 1 ( 4.2) | 1 |
| 血管障害 | 1 ( 4.2) | 1 |
| 高血圧 | 1 ( 4.2) | 1 |
MedDRA/J version 17.0
注3:同一患者において同一の器官別大分類又は基本語の副作用が複数回発現した場合は、各分類で1例として取り扱った。 医療関係者向けサイト
医療関係者向けサイト

